
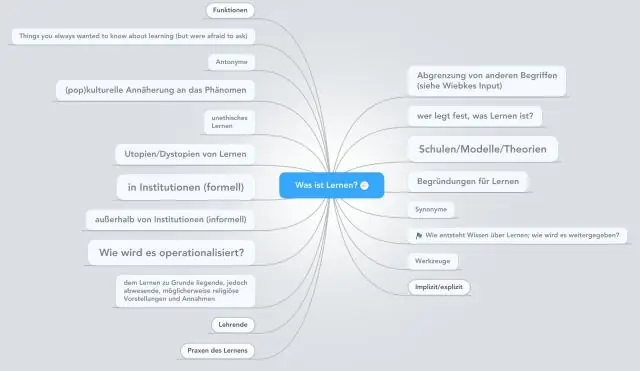
- Autors Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Pēdējoreiz modificēts 2025-01-22 17:04.
endergoniska reakcija . ne-spontāna ķīmiska viela reakcija , kurā no apkārtnes tiek absorbēta brīvā enerģija. ATP (adenozīna trifosfāts) ir adenīnu saturošs nukleozīdu trifosfāts, kas atbrīvo brīvo enerģiju, kad tā fosfātu saites tiek hidrolizētas.
Kas ir endergoniskas reakcijas piemērs?
Piemēri no endergoniskās reakcijas ietver endotermiskās reakcijas , piemēram, fotosintēze un ledus kušana šķidrā ūdenī. Ja apkārtējā temperatūra pazeminās, reakcija ir endotermisks.
Zināt arī, kas ir endergoniskā reakcija bioloģijā? Ķīmiskajā termodinamikā an endergoniska reakcija (ko sauc arī par siltuma absorbciju, kas nav spontāna reakcija vai nelabvēlīgs reakcija ) ir ķīmiska viela reakcija kurā brīvās enerģijas standarta izmaiņas ir pozitīvas un enerģija tiek absorbēta.
Šajā sakarā kāda ir endergoniskās reakcijas viktorīnas definīcija?
a reakcija kurā produktiem ir vairāk enerģijas nekā reaģentiem. Augi izmanto saules gaismu, lai pārvērstu oglekļa dioksīdu un ūdeni cukurā un skābeklī.
Kāda ir atšķirība starp eksergonisko reakciju un endergonisko reakciju viktorīnu?
Eksergoniskas reakcijas ietver jonu saites; endergoniskās reakcijas ietver kovalentās saites. In eksergoniskas reakcijas , reaģentiem ir mazāka ķīmiskā enerģija nekā produktiem; iekšā endergoniskās reakcijas , ir otrādi. Eksergoniskas reakcijas ietver obligāciju saraušanu; endergoniskās reakcijas ietver saišu veidošanos.
Ieteicams:
Kas ir ķīmisko reakciju laboratorija?

Ķīmiskā reakcija jeb ķīmiskās izmaiņas ir process, kurā dažas vielas pārvēršas citās, mainot to ķīmisko sastāvu un ķīmiskās saites
Kas ir ķīmisko reakciju sadursmes teorija?

Sadursmes teorija, teorija, ko izmanto, lai prognozētu ķīmisko reakciju ātrumu, īpaši gāzēm. Sadursmes teorija balstās uz pieņēmumu, ka reakcijai ir nepieciešams, lai reaģējošās sugas (atomi vai molekulas) sanāktu kopā vai saduras viena ar otru
Ko jūs domājat ar pārejošu reakciju un līdzsvara stāvokļa reakciju?

Pārejoša reakcija Pēc ievades ievadīšanas vadības sistēmai, izvadei nepieciešams noteikts laiks, lai sasniegtu līdzsvara stāvokli. Tātad izvade būs pārejošā stāvoklī, līdz tā nonāks līdzsvara stāvoklī. Tāpēc vadības sistēmas reakcija pārejas stāvokļa laikā ir pazīstama kā pārejoša reakcija
Kāda ir galvenā atšķirība starp eksergonisko un endergonisko reakciju viktorīnu?
Eksergoniskās reakcijas atbrīvo enerģiju; endergonicreactions to absorbē. Eksergoniskās reakcijas ietver jonu saites; endergoniskās reakcijas ietver kovalentās saites. Neeksergoniskas reakcijas, reaģentiem ir mazāka ķīmiskā enerģija nekā produktiem; endergoniskajās reakcijās ir tieši pretēji
Kāda ir atšķirība starp eksergonisko reakciju un endergonisko reakciju viktorīnu?

Eksergoniskās reakcijas ietver jonu saites; endergoniskās reakcijas ietver kovalentās saites. Eksergoniskās reakcijās reaģentiem ir mazāka ķīmiskā enerģija nekā produktiem; endergoniskajās reakcijās ir otrādi. Eksergoniskās reakcijas ir saistītas ar saišu pārtraukšanu; endergoniskās reakcijas ietver saišu veidošanos
