
Satura rādītājs:
- Autors Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:17.
- Pēdējoreiz modificēts 2025-01-22 17:05.
Šķīduma entalpija (šķīduma siltums) Piemērs
- Aprēķināt uz karstums atbrīvots, q, džoulos (J), ar reakcija : q = masa (ūdens) × īpatnējais karstums jauda (ūdens) × temperatūras izmaiņas ( risinājums )
- Aprēķināt izšķīdušās vielas moli (NaOH(s)): moli = masa ÷ molmasa.
- Aprēķināt uz entalpija izmaiņas, ΔH, kJ mol-1 no izšķīdušās vielas:
Tāpat kā jūs atrodat veidošanās siltumu?
Šis vienādojums būtībā nosaka, ka standarts entalpija maiņa veidošanās ir vienāds ar standarta entalpiju summu veidošanās no produktiem mīnus standarta entalpiju summa veidošanās no reaģentiem. un standarts veidošanās entalpija vērtības: ΔH fo[A] = 433 KJ/mol. ΔH fo[B] = -256 KJ/mol.
Pēc tam rodas jautājums, ko nozīmē šķīduma siltums? Definīcija no šķīduma siltums .: karstums attīstījās vai uzsūcas, kad viela īpaši izšķīst: daudzums, kas rodas, kad viens mols vai dažreiz viens grams izšķīst lielā šķīdinātāja pārpalikumā.
Ziniet arī, kā aprēķināt siltuma izmaiņas?
Kad karstums ir iesaistīta pārsūtīšana, izmantojiet šo formulu: mainīt temperatūrā = Q / cm līdz aprēķināt uz mainīt temperatūrā no noteikta daudzuma karstums pievienots. Q apzīmē karstums pievienots, c ir konkrētais karstums karsējamās vielas jauda, un m ir karsējamās vielas masa.
Ko nozīmē degšanas siltums?
Degšanas siltums (ΔH°c) ir veidā atbrīvotās enerģijas daudzuma mērs karstums q) kad tiek sadedzināts viens mols vielas ( degšana ). Ražošana karstums nozīmē, ka reakcija ir eksotermisks process un izdala enerģiju.
Ieteicams:
Kā jūs atrisināt ideālās gāzes likumu?

Ideālās gāzes likuma formula Ideālās gāzes likuma formulas jautājumi: Atbilde: tilpums ir V = 890,0 ml un temperatūra ir T = 21°C un spiediens ir P = 750 mmHg. PV = nRT. Atbilde: Molu skaits ir n = 3,00 moli, temperatūra ir T = 24°C un spiediens P = 762,4 mmHg. PV = nRT
Kā jūs atrisināt daļskaitļu reizināšanu un dalīšanu?
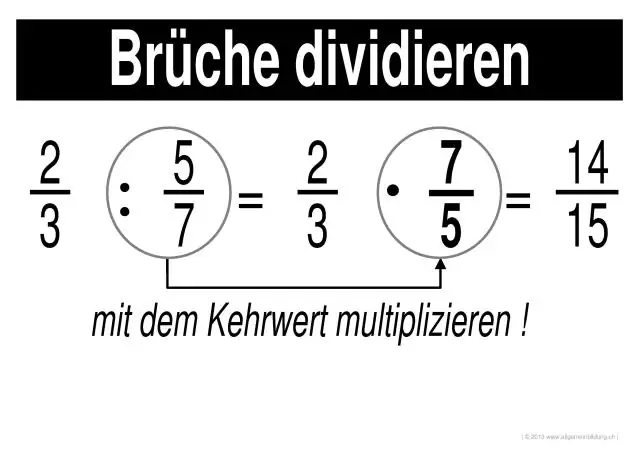
Daļskaitļu reizināšana un dalīšana 1. darbība: reiziniet katras daļskaitļa skaitītājus savā starpā (skaitļus augšpusē). Rezultāts ir atbildes skaitītājs. 2. darbība: reiziniet katras daļdaļas saucējus savā starpā (skaitļi apakšā). Rezultāts ir atbildes saucējs. 3. darbība. Vienkāršojiet vai samaziniet atbildi
Kā jūs atrisināt identitātes īpašumu?

Identitātes rekvizīts sastāv no divām daļām: aditīvā identitāte un multiplikatīvā identitāte. Pievienojiet skaitlim nulli (0), summa ir šis skaitlis. Reiziniet skaitli ar 1, produkts ir šis skaitlis. Sadaliet skaitli ar sevi, koeficients ir 1
Kā jūs pārvēršat Kelvinu no Celsija uz īpatnējo siltumu?

Īpatnējā siltumietilpība ir siltums, kas nepieciešams, lai paaugstinātu 1 g vielas temperatūru par 1 grādu pēc Celsija. 1 grāds pēc Celsija = 1 grāds Kelvina. Risinot īpatnējo siltumietilpību Kelvinos, Kelvin=Celsijs, jo attālums no viena grāda līdz nākamajam grādam gan pēc Celsija, gan Kelvina ir vienāds
Kā jūs aprēķināt šķīdināšanas siltumu?

Šķīduma siltums vai šķīduma entalpija ķīmijas apmācība Tiek aprēķināts atbrīvotās vai absorbētās enerģijas daudzums. q = m × Cg × ΔT. q = atbrīvotās vai absorbētās enerģijas daudzums. aprēķināt izšķīdušās vielas molus. n = m ÷ M. n = izšķīdušās vielas moli. Tiek aprēķināts atbrīvotās vai absorbētās enerģijas (siltuma) daudzums uz vienu molu izšķīdušās vielas. ΔHsoln = q ÷ n
