- Autors Miles Stephen [email protected].
- Public 2023-12-15 23:38.
- Pēdējoreiz modificēts 2025-01-22 17:05.
No no augšas uz leju uz leju a grupai , elektronegativitāte samazinās. Tas ir tāpēc, ka atomu skaits palielinās uz leju a grupai , un tādējādi ir palielināts attālums starp valences elektroniem un kodolu vai lielāks atomu rādiuss.
Ņemot to vērā, kāpēc atomu izmērs palielinās grupā?
Kopumā atomu rādiuss periodā samazinās un palielina grupu . Uz leju grupā , enerģijas līmeņu skaits (n) palielinās , tātad tur ir lielāks attālums starp kodolu un visattālāko orbitāli. Tā rezultātā tiek iegūts lielāks atomu rādiuss.
Kā arī, kāda ir tendence pirmajā jonizācijas enerģijā grupā no augšas uz leju? Pārvietojoties no kreisās puses uz labo punktu, atomu rādiuss samazinās, tāpēc elektroni vairāk tiek piesaistīti (tuvākajam) kodolam. Vispārējā tendence ir tāda, ka jonizācijas enerģija samazinās, virzoties no augšas uz leju periodiskās tabulas grupā. Pārvietojoties pa grupu uz leju, tiek pievienots valences apvalks.
Ziniet arī, kāda ir Valency variācijas periodiskā tendence, krītot uz leju?
» Visi a grupai ir vienāds valences elektronu skaits. » Atomu rādiuss parasti palielinās ejot lejā grupā sakarā ar jauna enerģijas līmeņa (čaulas) pievienošanu.
Kādu atomu rādiusa tendenci jūs redzat, ejot uz leju grupu saimē periodiskajā tabulā?
Spēcīgāks kodols pievelk elektronus tuvāk, saspiežot tos ciešāk kopā un galu galā samazinot atomu rādiuss . Kā tu ej lejā a ģimene periodiskajā tabulā , jonizācijas enerģija samazinās. Enerģijas līmeņu skaits palielinās kā tu ej lejā uz periodiskā tabula.
Ieteicams:
Kāda ir elektronegativitātes tendence, kas samazinās grupā?
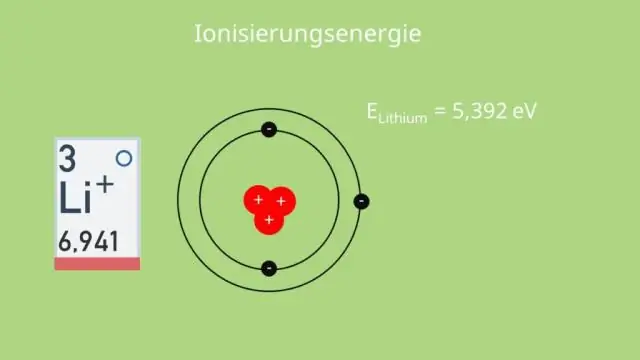
Tātad, virzoties uz leju pa grupu periodiskajā tabulā, elementa elektronegativitāte samazinās, jo palielinātais enerģijas līmeņu skaits nostāda ārējos elektronus ļoti tālu no kodola pievilkšanas. Elektronegativitāte palielinās, pārvietojoties no kreisās uz labo pusi periodiskajā tabulā
Kāda ir otrā jonizācijas enerģijas tendence?
Jonizācijas enerģijas tendences periodiskajā tabulā. Atoma jonizācijas enerģija ir enerģijas daudzums, kas nepieciešams, lai noņemtu elektronu no šī atoma vai jona gāzveida formas. Otrā jonizācijas enerģija ir gandrīz desmit reizes lielāka nekā pirmajai, jo samazinās elektronu skaits, kas izraisa atgrūšanos
Kā darbojas Aufbau princips, proti, tas nozīmē teikt, ka orbitāles tiek aizpildītas no apakšas uz augšu vai no augšas uz leju atkarībā no diagrammas)?

No apakšas uz augšu: telpas ir jāaizpilda no pirmā stāva uz augšu. Augstākos stāvos kārtība var nedaudz mainīties. Aufbau princips: elektroni aizpilda pieejamās orbitāles no zemākās enerģijas līdz augstākajai enerģijai. Pamatstāvoklī visi elektroni atrodas zemākajā iespējamajā enerģijas līmenī
Kas ir iedzīvotāju kontrole no augšas uz leju un no apakšas uz augšu?

Ir 2 populācijas kontroles veidi: augšupēja kontrole, ko nosaka resursi, kas nodrošina izaugsmi, piemēram, pārtikas avots, biotops vai telpa, un lejupejoša kontrole, ko nosaka tādi faktori, kas kontrolē nāvi, piemēram, kā plēsonība, slimības vai dabas katastrofas
Kāpēc periodiskā tabula ir sakārtota pēc atomu skaita, nevis pēc atomu masas?

Kāpēc periodiskā tabula ir sakārtota pēc atomu skaita, nevis pēc atomu masas? Atomu skaits ir protonu skaits katra elementa atomu kodolā. Šis numurs ir unikāls katram elementam. Atomu masu nosaka protonu un neitronu skaits kopā
