
- Autors Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Pēdējoreiz modificēts 2025-01-22 17:05.
Lai atrastu parasti citēto jonizācijas enerģija , šī vērtība tiek reizināta ar atomu skaitu a kurmis ūdeņraža atomu (Avogadro konstante) un pēc tam dalot ar 1000, lai pārvērstu džouliem uz kilodžouli . Tas ir labi salīdzināms ar parasti norādīto ūdeņraža vērtību jonizācijas enerģija no 1312. gada kJ mol -1.
Kā jūs varat uzzināt be3+ jonizācijas enerģiju?
The jonizācijas enerģija ir arī proporcionāls Z^2, jo tā ir atšķirība starp atoma/jona pamatstāvokli un enerģiju atdalītā jona plus elektrons. Be^(4+) lādiņš ir četras reizes lielāks par H^+, tātad jonizācijas enerģija Be^(3+) ir 4^2 jeb 16 reizes lielāks par H.
Līdzīgi, kam tiek izmantota jonizācijas enerģija? Jonizācijas enerģija ir svarīgi, jo tā var būt pieraduši palīdz prognozēt ķīmisko saišu stiprumu. Vienības: Jonizācijas enerģija tiek ziņots kilodžoulos uz molu (kJ/mol) vai elektronvoltos (eV).
Pēc tam var arī jautāt, kā jūs aprēķināt jonizācijas potenciālu?
Izdaliet jonizēto masu gramos ar atommasas skaitli. Ja jums ir, piemēram, 24 grami skābekļa, kura atomu masa ir 16, jums ir 1,5 moli. Reiziniet jonizācija enerģija, kuru jūs uzmeklējāt par 96.485. 1 eV/daļiņa ir vienāda ar 96,485 kJ/mol.
Kādi ir jonizācijas enerģijas piemēri?
The jonizācijas enerģija atoma daudzums ir enerģiju nepieciešams, lai noņemtu elektronu no šī atoma vai jona gāzveida formas. 1st jonizācijas enerģija - enerģiju nepieciešams noņemt augstāko enerģiju elektrons no neitrāla gāzveida atoma. Priekš Piemērs : Nē(g) → Na+(g) + e- es1 = 496 kJ/mol.
Ieteicams:
Kā aprēķināt elektromagnētiskā viļņa enerģiju?

Jebkura viļņa pārnestā enerģija ir proporcionāla tā amplitūdas kvadrātam. Elektromagnētiskajiem viļņiem tas nozīmē, ka intensitāti var izteikt šādi: Iave=cϵ0E202 Iave = c ϵ 0 E 0 2 2, kur Iave ir vidējā intensitāte W/m2, un E0 ir nepārtraukta sinusoidālā viļņa maksimālā elektriskā lauka stiprums
Kāda ir jonizācijas enerģija kJ mol slāpekļa?

Molekulārā slāpekļa jonizācijas enerģija ir 1503 kJ molα-1, bet atomu slāpekļa jonizācijas enerģija ir 1402 kJ molα-1. Atkal, elektronu enerģija molekulārajā slāpeklī ir mazāka nekā elektronu enerģija atdalītajos atomos, tāpēc molekula ir saistīta
Kā aprēķināt rotācijas kinētisko enerģiju?
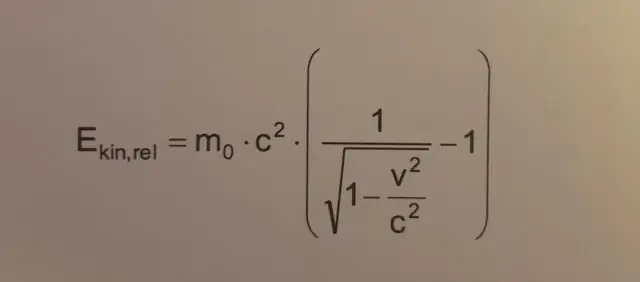
Rotācijas kinētisko enerģiju var izteikt šādi: Erotācijas=12Iω2 E rotācijas = 1 2 I ω 2 kur ω ir leņķiskais ātrums un I ir inerces moments ap griešanās asi. Rotācijas laikā pielietotais mehāniskais darbs ir griezes momenta reizinājums ar griešanās leņķi: W=τθ W = τ θ
Kā kuloniskā pievilcība ietekmē jonizācijas enerģiju?

Jo lielāka ir jonizācijas enerģija, jo grūtāk ir noņemt elektronu. Izmantojot tās pašas kuloniskās piesaistes idejas, mēs varam izskaidrot pirmās jonizācijas enerģijas tendences periodiskajā tabulā. Jo lielāka ir atoma elektronegativitāte, jo lielāka ir tā spēja piesaistīt elektronus sev
Kā Kulona likums attiecas uz jonizācijas enerģiju?

Atoma jonizācijas enerģija ir enerģijas starpība starp elektronu, kas saistīts atomā, un elektronu bezgalīgā attālumā no atoma. Kulona likums nosaka elektrisko potenciālo enerģiju starp diviem punktveida lādiņiem ar attālumu r starp tiem. Enerģija ir apgriezti proporcionāla šim attālumam
