
- Autors Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Pēdējoreiz modificēts 2025-01-22 17:04.
Hloru izotops ar 18 neitroniem pārpilnība ir 0,7577 un masas skaits ir 35 amu. Lai aprēķinātu vidēji atommasa, reiziniet daļu ar katras masas skaitli izotops , pēc tam pievienojiet tos kopā.
Līdzīgi, kāds ir visu elementa izotopu vidējais svērtais lielums?
Izmantojot dažādu masu izotopi un cik bagātīgs katrs izotops ir, mēs varam atrast vidēji an atomu masa elements . An atommasa elements ir vidējais svērtais atomu masa dabā sastopamā paraugā elements . Atomu masu parasti norāda atomu masas vienībās.
kam ir 1 amu masa? Atomu masas vienība (simbolizēta AMU vai amu) ir definēta kā precīzi 1/12 no oglekļa-12 atoma masas. Oglekļa-12 (C-12) atomam ir seši protoni un seši neitroni savā kodolā. Neprecīzā izteiksmē viens AMU ir vidējais rādītājs protonu atpūtas masa un neitronu atpūtas masa.
Otrkārt, kā jūs aprēķināt procentuālo daudzumu, izmantojot atomu masu?
Mainiet katru procentuālā pārpilnība decimāldaļā, dalot ar 100. Reiziniet šo vērtību ar atomu masa šī izotopa. Saskaitiet kopā katram izotopam, lai iegūtu vidējo atomu masa.
Kāda ir atšķirība starp atomu masu un atomu svaru?
Atomu masa (ma) ir masa no an atoms . Viens atoms ir noteikts protonu un neitronu skaits, tāpēc masa ir nepārprotams (nemainīsies) un ir protonu un neitronu skaita summa atomā . Atomu svars ir vidējais svērtais rādītājs masa no visiem atomi elementa, pamatojoties uz izotopu pārpilnību.
Ieteicams:
Kā jūs interpretējat svērto vidējo?

Kopsavilkums. Svērtais vidējais: vidējais rādītājs, kurā dažas vērtības dod lielāku ieguldījumu nekā citas. Kad svari tiek pievienoti 1: vienkārši reiziniet katru svaru ar atbilstošo vērtību un visu summējiet. Pretējā gadījumā reiziniet katru svaru w ar atbilstošo vērtību x, summējiet visu un daliet ar svaru summu: svērtais vidējais = ΣwxΣw
Kā programmā Excel aprēķināt populācijas vidējo vērtību?
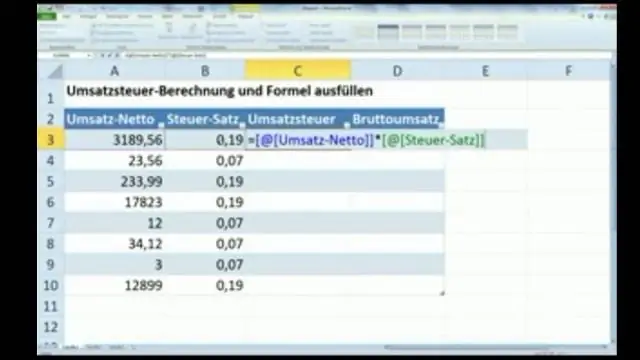
Vidējais iedzīvotāju skaits = visu vienumu summa / vienību skaits Populācijas vidējais = (14+61+83+92+2+8+48+25+71+12) / 10. Vidējais iedzīvotāju skaits = 416/10. Iedzīvotāju vidējais = 41,6
Kā programmā Excel atrast standarta novirzi un vidējo vērtību?
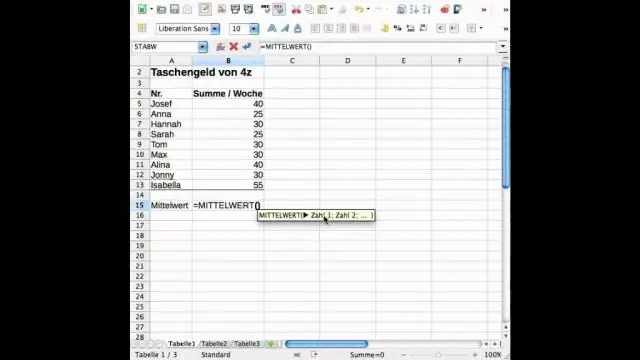
Standarta novirze ir mērījums, kas parāda, cik liela ir skaitļu kopas novirze salīdzinājumā ar skaitļu vidējo (vidējo). Lai programmā Excel aprēķinātu standarta novirzi, atkarībā no datu kopas varat izmantot vienu no divām galvenajām funkcijām. Ja dati atspoguļo visu populāciju, varat izmantot STDEV. Pfunkcija
Kā rakurstabulā izveidot vidējo svērto vērtību?

Svērtie vidējie rādītāji rakurstabulā Rakurstabulas rīkjoslas kreisajā pusē noklikšķiniet uz lejupvērstās bultiņas blakus vārdam PivotTable. Izvēlieties Formulas | Aprēķinātie lauki. Lodziņā Vārds ievadiet sava jaunā lauka nosaukumu. Lodziņā Formula ievadiet formulu, kuru vēlaties izmantot vidējam svērtajam, piemēram, =WeightedValue/Weight. Noklikšķiniet uz Labi
Kā tabulā atrodat vidējo un vidējo vērtību?
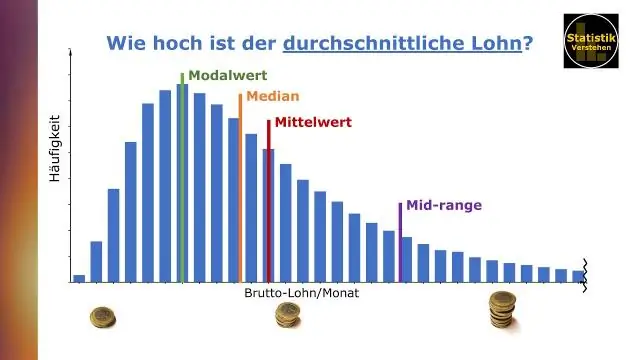
Datu paziņošana ar Bena Džounsa Tableau Vidējo (vai vidējo) nosaka, summējot visas datu kopas vērtības un dalot ar vērtību skaitu. Mediāna ir vidējā vērtība datu kopā, kurā vērtības ir sakārtotas pēc lieluma
