
- Autors Miles Stephen stephen@answers-science.com.
- Public 2023-11-26 05:40.
- Pēdējoreiz modificēts 2025-01-22 17:04.
Vielas daudzuma SI pamatvienība ir kurmis . 1 kurmis ir vienāds ar 1 moli Sēra dioksīds , jeb 64,0638 grami.
Vienkārši tā, kāda ir viena mola sēra dioksīda masa?
64,066 g/mol
Kā arī, kāda ir 0,75 molu so2 kopējā masa? Atbildēt kopējā masa 0,75 moli SO2 ir 48 grami. Paskaidrojums: Lai noteiktu kopējā masa gramos 0,75 moli SO2 , vispirms ir jānosaka molārs masa no savienojuma.
Attiecīgi kāda ir saražotā sēra dioksīda masa?
Molārs sēra masa ir 32,1 g/mol, un skābeklis ir 16,0 g/mol. Ja atskatāties uz formulu (SO2), jūs varat redzēt, ka tāda ir sērs un divi skābekļa avoti. Tāpēc molārs sēra dioksīda masa ir [1 × 32,1 + 2 × 16,0] = 64,1 g/mol.
Kāda ir 4,00 molu skābekļa gāzes masa?
Kopš skābeklis ir atoms masa no 16 g/ kurmis , molārs masa no skābekļa gāze ( O2 ) ir 2 x 16 g/ kurmis = 32 g/ kurmis . Kopš 1 mols skābekļa ir līdzvērtīgs 32 g, 4 moli skābekļa gāzes būtu līdzvērtīgi 4 kurmji x 32 g/ kurmis = 128 g.
Ieteicams:
Kāda ir sēra hibridizācija sf6?

Sēra atoms sēra heksafluorīdā, SF6, uzrāda sp3d2 hibridizāciju. Sēra heksafluorīda molekulā ir seši saistoši elektronu pāri, kas savieno sešus fluora atomus ar vienu sēra atomu. Uz centrālā atoma nav atsevišķu elektronu pāru
Kāda ir sēra dioksīda veidošanās standarta entalpija?

Lai pārbaudītu, tam jābūt (&mīnus;296,81±0,20) kJ/mol. Jums vajadzētu izmantot NIST biežāk. Tomēr es faktiski saņēmu & mīnus 310,17 kJ/mol. Vispirms ir jāatrod ΔH∘f SO3(g)
Kāda ir viena mola zelta masa?

196,96655 grami
Kāda būtu sēra jona S - 2 elektronu konfigurācija?

Sēram ir 16 elektroni. Sēram tuvākā cēlgāze ir argons, kura elektronu konfigurācija ir: 1s22s22p63s23p6. Lai sērs būtu izoelektronisks ar argonu, kurā ir 18 elektroni, tam ir jāiegūst divi elektroni. Tāpēc sērs veidos 2-jonu, kļūstot par S2
Kad gāzes parauga tilpums tiek samazināts, gāzes parauga spiediens?
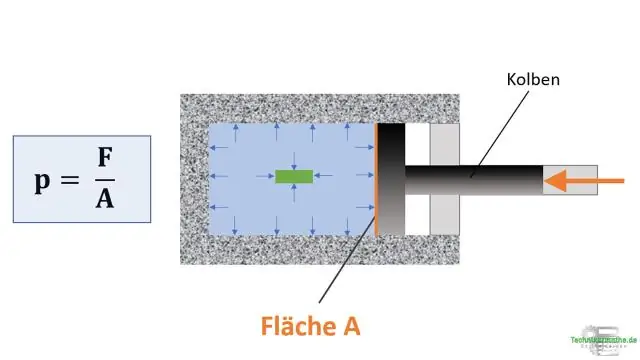
Spiediena samazināšana Kombinētais gāzes likums nosaka, ka gāzes spiediens ir apgriezti saistīts ar tilpumu un tieši saistīts ar temperatūru. Ja temperatūra tiek uzturēta nemainīga, vienādojums tiek reducēts līdz Boila likumam. Tāpēc, ja samazināsiet noteikta daudzuma gāzes spiedienu, tā tilpums palielināsies
