
- Autors Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Pēdējoreiz modificēts 2025-01-22 17:05.
The veidošanās entalpija priekš an elements elementārajā stāvoklī vienmēr būs 0 jo nav nepieciešama enerģija, lai izveidotu dabiski sastopamu savienojumu. Kad viela ir veidojas no tās stabilākās formas elementi , izmaiņas entalpija notiek.
Līdzīgi var jautāt, kādām vielām veidošanās entalpija ir nulle?
Visi elementi to standarta stāvoklī (skābekļa gāze, cieta viela ogleklis formā grafīts u.c.) standarta veidošanās entalpija ir nulle, jo to veidošanās nav saistīta ar izmaiņām.
Pēc tam rodas jautājums, kāda ir ūdens veidošanās entalpija? Izvēlētā ATcT veidošanās entalpija, pamatojoties uz termoķīmiskā tīkla versiju 1.118
| Sugas nosaukums | Formula | ΔfH° (298,15 K) |
|---|---|---|
| Ūdens | H2O (kr, ekv.prese) | -292.740 |
Attiecīgi, kāpēc dimanta veidošanās standarta entalpija nav nulle, lai gan tas ir elements?
The standarta veidošanās entalpija priekš an elements tajā standarta valsts ir NULLE !!!! Tātad ΔH°f C (s, grafīts) ir nulle , bet ΔH°f C (s, dimants ) ir 2 kJ/mol. Tas ir tāpēc, ka grafīts ir standarta oglekļa stāvoklis, nevis dimants.
Ko tas nozīmē, ja delta h ir nulle?
Viņi var izmērīt tikai entalpijas izmaiņas. Kad entalpija ir pozitīva un delta H ir labāks par nulle , šis nozīmē ka sistēma absorbē siltumu. To sauc par endotermisku reakciju. Kad entalpija ir negatīva un delta H ir mazāks par nulle , šis nozīmē ka sistēma izdala siltumu. To sauc par eksotermisku reakciju.
Ieteicams:
Kāpēc inducētais emf ir nulle, ja magnētiskā plūsma ir maksimāla?

Kad spole ir vertikāli, magnētiskā plūsma nemainās (t.i., emf = 0), jo spole "negriežas pāri" lauka līnijām. Inducētais emf ir nulle, ja spoles ir perpendikulāras lauka līnijām, un maksimālais, ja tās ir paralēlas. Atcerieties, ka inducētais emf ir magnētiskās plūsmas savienojuma izmaiņu ātrums
Kāpēc EMF ir nulle, kad spole iet caur precīzu magnēta centru?
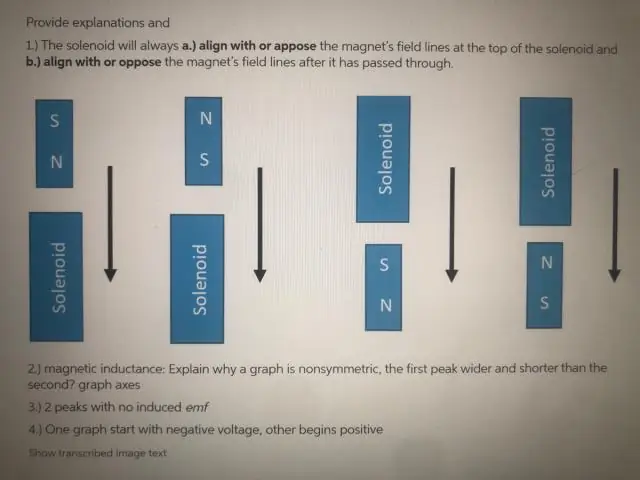
Emf ir tikai nulle uz brīdi, kad magnēts iet caur precīzu spoles centru. Tas ir tāpēc, ka magnēta vienā galā esošā N pola ietekmi uz šo spoles galu precīzi atceļ magnēta S pola ietekme uz spoles otru galu
Kāda ir sēra dioksīda veidošanās standarta entalpija?

Lai pārbaudītu, tam jābūt (&mīnus;296,81±0,20) kJ/mol. Jums vajadzētu izmantot NIST biežāk. Tomēr es faktiski saņēmu & mīnus 310,17 kJ/mol. Vispirms ir jāatrod ΔH∘f SO3(g)
Kāda ir Cao veidošanās entalpija?

Savienojuma veidošanās siltumu tabula ΔHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Kāpēc sanesuši gruntsūdeņi tiek uzskatīti par iegrimju veidošanās pazīmi?

Izlietnes ir saistītas ar ūdeni. Ūdens klintī izšķīdināja minerālus, atstājot iežos atlikumus un brīvas vietas. Ūdens izskalo augsni un atlikumus no akmeņu tukšumiem. Gruntsūdens līmeņa pazemināšanās var izraisīt mīkstā materiāla atbalsta zudumu klinšu telpās, kas var izraisīt sabrukšanu
