
- Autors Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:17.
- Pēdējoreiz modificēts 2025-01-22 17:05.
The likme no ķīmiskas vielas reakcija ir koncentrācijas izmaiņas laika izmaiņas.
Reakcijas ātrumu var definēt šādi:
- pazušanas ātrums no A likme =−Δ[A]Δt.
- pazušanas ātrums no B likme =−Δ[B]Δt.
- veidošanās ātrums no C likme =Δ[C]Δt.
- veidošanās ātrums no D) likme =Δ[D]Δt.
Līdzīgi, kā aprēķināt reakcijas ātrumu?
Jūs varat izteikties reakcijas ātrumi molu vienībās litrā sekundē vai mol × L-1 × s-1. Uz aprēķināt a reakcijas ātrums , vienkārši sadaliet saražotās vai patērētās vielas molus reakcija un dala ar reakcija laiks sekundēs.
Var arī jautāt, kāds ir veidošanās ātrums? The likme reakcija ir vienāda ar, R = veidošanās ātrums jebkura reakcijas komponenta / izmaiņas laikā. Šeit šajā reakcijā notiek O2 veidojas , tātad likme reakcija būtu likme ar kuru O2 ir veidojas.
Ņemot to vērā, vai pazušanas ātrums vienmēr ir tāds pats kā parādīšanās ātrums?
14.17 (c) Vai izzušanas ātrums no reaģentiem vienmēr tāds pats kā parādīšanās ātrums no produktiem? Nē. Reaģentu un produktu molu attiecībām jābūt zināmām, lai tās būtu saistītas pazušanas ātrums no reaģentiem uz izskata ātrums no produktiem. The likme pārgriezīs uz pusēm.
Kāds ir pazušanas ātrums?
Tie abi ir saistīti ar līdzsvarotām ķīmiskām reakcijām, un abus var izmantot reakcijas mērīšanai likme . Piemēram, vienkāršajā reakcijā A+B→C+D. Reakcija likme var definēt šādi: pazušanas ātrums no A likme =−Δ[A]Δt. pazušanas ātrums no B likme =−Δ[B]Δt.
Ieteicams:
Kā jūs atrodat ātrumu un ietilpību Scrum?

Sprintā piegādāto stāsta punktu skaitu/demonstrāciju sauc par ātrumu. Piemēram, ja komanda sprintā plānoja 30 stāsta punktu (biznesa vērtība) vērtu lietotāju stāstus un spēj nodrošināt, kā plānots, tad komandas ātrums ir 30. Kāda ir komandas kapacitāte? Kopējais sprintam pieejamo stundu skaits tiek saukts par komandas kapacitāti
Kā jūs atrodat vidējā ātruma aprēķinus?

(b) Vidējais ātrums ir slīpuma līnijas slīpums, nevis pieskares līnijas slīpums. Atrast vidējo ātrumu ir viegli. Pievienojiet pozīcijas vienādojumam t = 2 un t = 3, lai aprēķinātu objekta augstumu norādītā intervāla robežās, lai izveidotu divus sakārtotus pārus: (2, 1478) un (3, 1398)
Kā jūs atrodat paātrinājumu no ātruma?
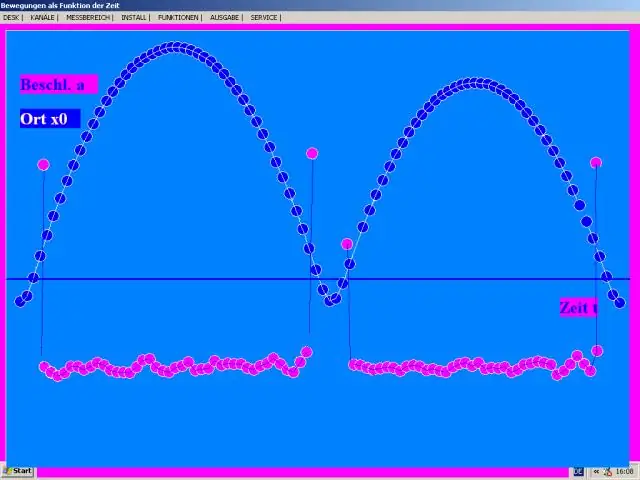
Paātrinājuma aprēķināšana ietver ātruma dalīšanu ar laiku vai SI vienību izteiksmē, skaitītāja sekundē [m/s] dalīšanu ar sekundi [s]. Divreiz dalīt attālumu ar laiku ir tas pats, kas dalīt attālumu ar laika kvadrātu. Tādējādi paātrinājuma SI vienība ir metrs sekundē kvadrātā
Kā jūs varat atrast vidējo ātrumu ātruma un laika grafikā?

Laukums zem ātruma/laika līknes ir kopējā nobīde. Ja jūs to dalāt ar laika izmaiņām, jūs iegūsit vidējo ātrumu. Ātrums ir ātruma vektora forma. Ja ātrums vienmēr nav negatīvs, tad vidējais ātrums un vidējais ātrums ir vienādi
Kā jūs atrodat ātruma un laika grafiku?

Līnijas slīpums grafikā pozīcija pret laiku ir vienāds ar objekta ātrumu. Līnijas slīpums ātruma un laika grafikā ir vienāds ar objekta paātrinājumu
