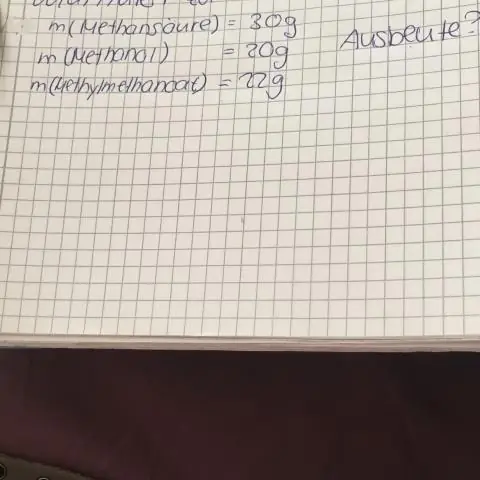
- Autors Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:17.
- Pēdējoreiz modificēts 2025-01-22 17:05.
- Moli un molārie šķīdumi (vienība = M = moli/l)
- Procenti Šķīdumi (% = daļas uz simtu vai grami/100 ml)
- Lai pārvērstu no % šķīduma uz molaritāte , reiziniet %risinājumu ar 10, lai izteiktu procentiem šķīduma grami/l, pēc tam dala pēc formulas svara.
Kā aprēķināt molaritāti?
Uz aprēķināt molaritāti , sadaliet izšķīdušās vielas molu skaitu ar šķīduma tilpumu litros. Ja jūs nezināt izšķīdušās vielas molu skaitu, bet zināt masu, sāciet ar izšķīdušās vielas molārās masas atrašanu, kas ir vienāda ar visām katra elementa molārām masām kopā pievienotajā šķīdumā.
Tāpat kā jūs aprēķināt molaritāti no normalitātes? Ja jūs zināt, Molaritāte skābes vai bāzes šķīdumā, varat to viegli pārvērst par Normalitāte reizinot Molaritāte pēc ūdeņraža (orhidroksīda) jonu skaita skābē (vai bāzē). Priekš piemērs , 2 MH2SO4 šķīdumam būs a Normalitāte 4N (2 M x 2 hidrogēnjoni).
Otrkārt, kā atrast risinājuma procentus?
Uz aprēķināt masu procentiem vai svars procentiem no a risinājums , izšķīdušās vielas masa ir jāsadala ar tās masu risinājums (gan šķīdinātāju, gan šķīdinātāju kopā) un pēc tam reiziniet ar 100, lai to mainītu procentiem.
Cik molu ir HCl?
1 mols
Ieteicams:
Kā aprēķināt hlora procentuālo daudzumu?

Hlora izotopam ar 18 neitroniem ir 0,7577 pārpilnība un 35 amu masas skaits. Lai aprēķinātu vidējo atommasu, reiziniet daļu ar katra izotopa masas skaitli un pēc tam pievienojiet tos kopā
Kā jūs varat atrast teorētisko skābekļa procentuālo daudzumu KClO3?

Izmantojot šo vienādojumu, tiek aprēķināts eksperimentālais skābekļa daudzums KClO3 paraugā. Eksperimentālie skābekļa procenti = zaudētā skābekļa masa x 100 KClO3 masa. Kālija hlorāta skābekļa % teorētisko vērtību aprēķina pēc formulas KClO3 ar molāro masu = 122,6 g/mol
Kā atrast molaritāti no blīvuma un procentiem?

Molaritāte ir šķīdinātāja molu skaits uz litru šķīduma. Pārvērtiet blīvumā, reizinot molu skaitu ar savienojuma molekulmasu. Pārvērtiet blīvumu par molaritāti, pārvēršot gramos litru un dalot ar savienojuma molekulmasu, gramos
Kā jūs varat atrast aptuveno procentuālo daudzumu, izmantojot empīrisko noteikumu?

Laukuma zem līknes atrašana no x = 9 līdz x = 13. Empīriskais noteikums jeb 68-95-99,7% noteikums sniedz aptuveno to datu procentuālo daudzumu, kas ietilpst vienas standarta novirzes (68%), divu standartnoviržu (95%) robežās. , un trīs standarta novirzes (99,7%) no vidējā
Kā aprēķināt tīrības procentuālo daudzumu?
% tīrība = g iegūtās tīras vielas ÷ gof dotajam paraugam × 100. Vielas procentuālo tīrību var aprēķināt, dalot tīrās ķīmiskās vielas masu ar kopējo parauga masu un pēc tam reizinot šo skaitli ar 100
