- Autors Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Pēdējoreiz modificēts 2025-01-22 17:05.
% tīrība = iegūtās tīrās vielas g ÷ gof dotais paraugs ×100. Tīrības procents viela var būt aprēķināts dalot tīrās ķīmiskās vielas masu ar kopējo parauga masu un pēc tam reizinot šo skaitli ar 100.
Vai procentuālā tīrība ir tāda pati kā procentuālā ražība?
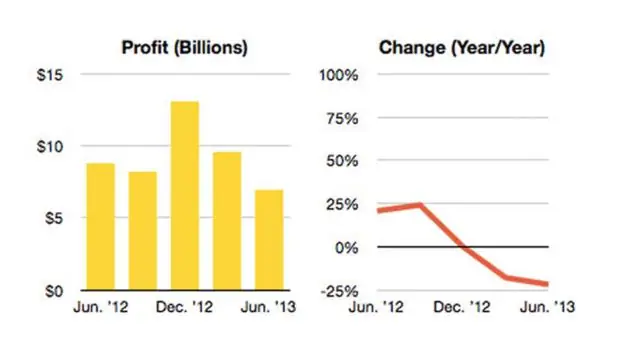
Ienesīgums procentos & Tīrības procents . Šajās nodarbībās mēs apsvērsim, kā to izdarīt aprēķināt uz procentu raža no reakcijas un tīrības procents no iegūtā produkta. The raža ir produkta daudzums, ko iegūstat no reakcijas. Pieņemsim, ka mums pieder rūpnīca, kas ražo mēslojumu vai krāsas.
Pēc tam rodas jautājums, kāda ir atšķirība starp tīrību un testu? Galvenais atšķirība starp testu un tīrība vai tas ir an tests ir viena no galvenajām sastāvdaļām noteikšana iekšā paraugs turpretim tīrība ir piemaisījumu noteikšana iekšā paraugs. Pārbaude un tīrība ir divu veidu mērījumi, ko izmanto, lai noteiktu parauga sastāvdaļas.
Ziniet arī, kā pārbaudīt sāls tīrību?
Kopīgs sāls , katra savienojuma molu attiecība ir 1 pret 1. Tīrība kopīgu sāls savienojumu var noteikt, zinot parauga molāro masu, katra elementa molāro masu un procentuālās sastāva standartvērtības. sāls tas ir tīrākais.
Kā noteikt tīru vielu?
Tīras vielas ir definēti kā vielas kas ir izgatavoti tikai no viena veida atoma vai molekulas. Tīrība a viela ir mērs, cik lielā mērā dotais viela ir tīrs . Fizikālās īpašības a tīra viela ietver skaidri noteiktus kušanas un viršanas punktus.
Ieteicams:
Kā aprēķināt hlora procentuālo daudzumu?

Hlora izotopam ar 18 neitroniem ir 0,7577 pārpilnība un 35 amu masas skaits. Lai aprēķinātu vidējo atommasu, reiziniet daļu ar katra izotopa masas skaitli un pēc tam pievienojiet tos kopā
Kā jūs varat atrast teorētisko skābekļa procentuālo daudzumu KClO3?

Izmantojot šo vienādojumu, tiek aprēķināts eksperimentālais skābekļa daudzums KClO3 paraugā. Eksperimentālie skābekļa procenti = zaudētā skābekļa masa x 100 KClO3 masa. Kālija hlorāta skābekļa % teorētisko vērtību aprēķina pēc formulas KClO3 ar molāro masu = 122,6 g/mol
Kā jūs varat atrast aptuveno procentuālo daudzumu, izmantojot empīrisko noteikumu?

Laukuma zem līknes atrašana no x = 9 līdz x = 13. Empīriskais noteikums jeb 68-95-99,7% noteikums sniedz aptuveno to datu procentuālo daudzumu, kas ietilpst vienas standarta novirzes (68%), divu standartnoviržu (95%) robežās. , un trīs standarta novirzes (99,7%) no vidējā
Kā jūs aprēķināt procentuālo molaritāti?
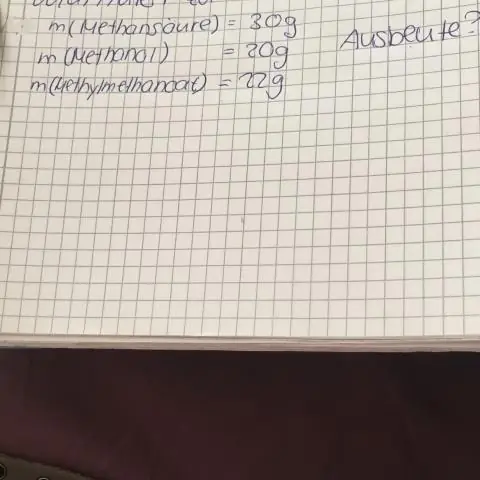
Moli un molārie šķīdumi (vienība = M = moli/L) Procentuālie šķīdumi (% = daļas uz simtu vai grami/100 ml) Lai pārvērstu no % šķīduma uz molaritāti, reiziniet šķīduma % ar 10, lai izteiktu šķīduma procentuālo daudzumu gramos/l, pēc tam sadaliet pēc formulas svara
Kā atrast atomu procentuālo daudzumu?
Lai atrastu elementa masas procentuālo sastāvu, elementa masas devu izdaliet ar kopējo molekulmasu. Pēc tam šis skaitlis ir jāreizina ar 100%, lai to izteiktu procentos
